Toistuvien Clostridioides difficilen elävien bioterapioiden tutkiminen
US Pharm. 2024;49(12):19-23.
TIIVISTELMÄ: Toistuvien Clostridioides difficile -infektioiden hoidossa antibioottien vaihtoehtojen tutkiminen on välttämätöntä, koska on olemassa riski, että suoliston mikrobiota häiriintyy entisestään. Näitä vaihtoehtoja ovat perinteinen ulosteen mikrobiotan siirto (FMT) ja uudemmat FMT-tyypit elävien bioterapeuttisten tuotteiden (LBP) muodossa. Vaikka perinteinen FMT luottaa standardoimattomiin luovuttajien ulostenäytteihin, LBP:t tarjoavat yhtenäisemmän ja johdonmukaisemman lähestymistavan mikrobiotan siirtoon. FDA on hyväksynyt kaksi LBP:tä, Rebyotan ja Vowstin, lääkelaadun vaihtoehdoiksi, ja lisätuotteita on kehitteillä. Farmaseuteilla on keskeinen rooli valistaessaan potilaita näiden tuotteiden alkuperästä ja terapeuttisista tehtävistä.
Clostridioides difficile on itiöitä muodostava bakteeri, joka on ensisijaisesti vastuussa tarttuvan ripulin aiheuttamisesta, erityisesti potilailla, joita on äskettäin hoidettu antibiooteilla, kuten fluorokinoloneilla, tietyillä kefalosporiineilla ja klindamysiinillä. Näiden ja muiden antibioottien antaminen häiritsee suoliston mikrobiota, mikä mahdollistaa C ero kolonisoitumaan ja lisääntymään suolistossa. C ero infektio (CDI) on yleisin terveydenhuoltoon liittyvä infektio, joka pidentää sairaalahoitoa ja lisää kuolleisuutta. 1
Historiallisesti metronidatsoli ja vankomysiini, molemmat suhteellisen laajakirjoiset antibiootit, olivat CDI:n vakiohoitoja. Nämä lääkkeet liittyvät pettymysttävän korkeaan CDI:n uusiutumisasteeseen, kuitenkin todennäköisesti siksi, että ne häiritsevät suoliston mikrobiota hoidon aikana. 2 Fidaksomisiinilla, kapeamman spektrin antibiootilla, on huomattavasti pienempi uusiutumisaste ja parempi turvallisuusprofiili vankomysiiniin verrattuna. 1.2 Tämän uudemman vaihtoehdon käyttöönotto on kuitenkin rajoitettu sen korkeiden kustannusten vuoksi. 1
CDI:n toistuvat jaksot
CDI:n hoito on tunnetusti haastavaa, ja toistuvat infektiot muodostavat merkittäviä esteitä, jotka vaativat innovatiivisia lähestymistapoja. Suuri kansanterveysongelma, toistuva C ero infektiot (rCDI:t) edellyttävät usein ulosteen mikrobiotasiirtoa (FMT) kahden tai useamman toistuvan episodin jälkeen. FMT, joka sisältää suoliston mikrobiomin palauttamisen joko luovuttajien ulostenäytteitä tai viljeltyjä solupankkeja käyttämällä, on osoittanut lupaavia tuloksia eri sovelluksissa.
Ensimmäisen CDI-jakson jälkeen potilailla on jopa 25 %:n riski saada rCDI, ja potilailla, joilla on useita uusiutumista, on jopa 75 %:n todennäköisyys myöhempään uusiutumiseen. 2 Infectious Diseases Society of America (IDSA) ja Society for Healthcare Epidemiology of America (SHEA) määrittelevät rCDI:n uusiutumiseksi 8 viikon sisällä edellisen jakson ratkaisemisesta, jopa onnistuneen hoidon jälkeen. 1 Heidän ohjeissaan suositellaan FMT:n harkitsemista vaihtoehtoisena hoitona rCDI-potilaille antibioottihoidon päätyttyä. 3 IDSA ehdottaa, että FMT:tä tulisi tarjota vain asianmukaisten antibioottihoitojen jälkeen vähintään kahden uusiutumisen (eli kolmen CDI-jakson) aikana. 3
Mikä on FMT?
FMT on toimenpide, jolla terveiden luovuttajien uloste viedään potilaan suolistoon palauttamaan hänen suoliston mikrobiotansa terveeksi. 4 Se sisältää minimaalisesti prosessoitujen mikro-organismien siirtämisen luovuttajalta vastaanottajalle ja ulostemateriaalia, jota käytetään erityisesti tässä prosessissa. Ulostenäytteet laimennetaan tyypillisesti steriileillä nesteillä ja annetaan pian valmistuksen jälkeen. 5 Ne annetaan yleensä peräsuolen kautta peräruiskeen kautta kolonoskopian aikana tai nenä-mahaletkujen tai nenäpohjukaissuolen letkujen kautta. 5.6 Oraalinen FMT pitkävaikutteisten kapseleiden kautta on osoittanut tehokkuutta, joka on verrattavissa muihin toimitusmenetelmiin, ja sitä on saatavana ulostepankeista ja tutkimuskeskuksista. 6 Tämä vaihtoehto sopii potilaille, jotka eivät tarvitse kolonoskopiaa ja voivat sietää oraalista antoa, vaikka nuoremmat lapset eivät yleensä ole ehdokkaita kapselien koon ja lukumäärän vuoksi. 6
Kunkin FMT-toimenpiteen mikrobikoostumus voi vaihdella merkittävästi johtuen eroista luovuttajan ulosteessa ja eri laitosten käyttämissä valmistusmenetelmissä. 5 Vaikka mahdollisten FMT-luovuttajien on läpäistävä perusteellinen seulonta ja valinta, on vain vähän tietoa siitä, kuinka luovuttajan ominaisuudet vaikuttavat FMT-tuloksiin. 5.6 Nykyiset suositukset luovuttajien valintaan perustuvat pikemminkin asiantuntijalausuntoihin kuin vankoihin todisteisiin. 6 Tämä standardoinnin puute ja seulontakäytäntöjen vaihtelevuus asettavat haasteita sekä sääntelijöille että kliinikoille, mikä tekee FMT-valmisteesta enemmän taidetta kuin tiedettä. 6
FMT on erittäin tehokas CDI:n uusiutumisen estämisessä, koska se populoi suoraan suoliston mikrobiston eikä vain tukahduttaa C ero kasvua, mikä palauttaa mikrobiston monimuotoisuuden ja toiminnan. 7 FMT-hoito on saavuttanut ~ 92 %:n tehokkuuden rCDI:n hoidossa, ja se on osoittautunut paremmaksi kuin fidaksomisiini- ja standardiannosvankomysiinimonoterapiat, kun sitä käytetään lyhyen vankomysiinikuurin jälkeen. 1.8 Tutkimukset osoittavat, että FMT muuttaa merkittävästi vastaanottajan suoliston mikrobiomia, erityisesti bakteroidien runsautta, muistuttamaan tervettä luovuttajaa. 5
Elävät bioterapeuttiset tuotteet
Vaikka perinteisiä FMT-menetelmiä pidetään suhteellisen turvallisina, huolta on edelleen olemassa luovuttajan ulostemateriaalin hankinnasta ja sen siirtämisestä potilaille, erityisesti niille, joiden immuunivaste on heikentynyt. Tiukasta luovuttajien valintaprosessista huolimatta FDA on antanut FMT:tä koskevia turvallisuusvaroituksia patogeenisten bakteerikantojen leviämisriskin vuoksi. 2,5,9 Vuonna 2019 FDA antoi turvallisuusvaroituksen sen jälkeen, kun kahdelle immuunipuutteelliselle aikuiselle kehittyi invasiivinen Escherichia coli FMT:n jälkeisiä infektioita ja norovirus-gastroenteriittiä on raportoitu FMT:n vastaanottajilla oireettomista luovuttajista huolimatta. 5.9 Aspiraatio on riski, kun FMT toimitetaan endoskoopin kautta, ja yksi tapaus johtaa 80-vuotiaan rCDI-potilaan kuolemaan. 6 Lisäksi COVID-19-pandemia korosti patogeenien leviämisriskien merkitystä luovuttajalta vastaanottajalle, mikä asetti rajoituksia ja vaikeutti luovuttajien rekrytointia. 2,11,12 Kun otetaan huomioon nämä FMT:hen liittyvät huolenaiheet, syntyi tarve muotoilla yhtenäisiä FMT-tuotteita, joilla on parannettu turvallisuusprofiili ja samalla minimoida epäjohdonmukaisuudet.
FDA:n määritelmien mukaan elävät bioterapeuttiset tuotteet (LBP) ovat rokottamattomia biologisia aineita, jotka sisältävät eläviä organismeja, kuten bakteereja, ja joita käytetään ihmisten sairauksien tai tilojen ehkäisyyn, hoitoon tai parantamiseen. 2.5 LBP:t annetaan kohdennettuna FMT-hoidon muotona rCDI:n tavanomaisen antibioottihoidon päätyttyä. LBP:t eroavat perinteisestä FMT:stä, koska FDA on luokitellut ne biologisiksi lääkevalmisteiksi, mikä merkitsee näiden hoitojen sääntelyn muutosta, kuten TAULUKKO 1 . 2.5 Koska FMT sisältää marginaalisesti prosessoitua luovuttajan ulostetta, FDA luokittelee perinteisen FMT:n tutkimuslääkeaineeksi. 2 Sitä vastoin LBP:t on tuotettava hyvän valmistustavan ohjeiden mukaisesti, ja niitä on tutkittava kliinisissä tutkimuksissa FDA:n hyväksynnän saamiseksi, kuten farmaseuttiset lääkkeet. 2,5,11

Nykyiset LBP:t voidaan luokitella niiden mikrobilähteiden mukaan, joista yksi on peräisin ihmisluovuttajilta. Terveet ulosteen luovuttajat osallistuvat johdonmukaiseen 29 eri patogeenin seulomiseen tartuntariskin vähentämiseksi FDA:n ohjeiden mukaisesti. 5.12 Nämä tuotteet lisäävät valmistuksen standardointia, ja niihin sisältyy usein ylimääräinen suodatus ja käsittely bakteerivalikoiman tarkentamiseksi koko ulosteen luovutuksissa. Perinteisen FMT:n tapaan mikrobinäytteiden määrä ja monimuotoisuus voivat kuitenkin vaihdella luovuttajaperäisten LBP-erien välillä. FDA tunnustaa tämän vaihtelun ja odottaa luovuttajien ulostenäytteiden yleensä heijastavan laajemmalle väestölle tyypillistä mikrobikoostumusta.
Toisessa menetelmässä useiden mikrobien konsortio suunnitellaan lääkkeeksi käyttämällä solulinjaeristystä hyödyllisten bakteeriviljelmien spesifisen valikoiman toimittamiseksi. 13 LBP:n standardointi edustaa suurta harppausta eteenpäin FMT:ssä siirtymällä monimutkaisuudesta useiden tutkittavien uusien lääkesovellusten potentiaaliin massatuotantoon ja laajempaan saatavuuteen.
Kaupallisesti saatavilla olevat LBP:t
LBP:tä suositellaan uusiutumisen estämiseen potilailla, joilla on ollut kaksi tai useampia CDI-jaksoja vankomysiini- tai fidaksomisiinihoidon kapenevan jälkeen. 5.9 FDA on hyväksynyt kaksi LBP-tuotetta rCDI:n ehkäisyyn: Rebyota (fecal microbiota, live-jslm), hyväksytty vuonna 2022, ja Vowst (fecal microbiota itiöt, live-brpk), hyväksytty vuonna 2023. Vowstin arvioidaan maksavan 17 500 dollaria, kun taas Rebyota maksaa noin 9 100 dollaria, kuten esitetään TAULUKKO 2 . 1 Tämä kustannus voi kuitenkin olla perusteltua verrattuna rCDI:n sairaalahoidon korkeisiin kustannuksiin, jotka vaihtelevat 67 837 dollarista 82 268 dollariin. 10 Rebyota on kylmäsäilytetty ja suodatettu koko ulostetuote, joka sisältää monenlaisia ulosteen mikrobeja, mukaan lukien Bacteroides , joka toimitetaan peräsuolen kautta. 2,5,9,12 Pätevien luovuttajien uloste seulotaan rutiininomaisesti useille lääkkeille vastustuskykyisten kantojen varalta, ja jokainen Rebyota-erä testataan standardoinnin varmistamiseksi tiettyjen bakteerilajien halutuilla elävillä määrillä. 2.5 Suolen valmistelua ei tarvita ennen Rebyotan antamista, ja kerta-annostoimenpiteen tulisi tapahtua 24–72 tuntia viimeisen CDI-antibioottiannoksen jälkeen. 9 Terveydenhuollon tarjoaja antaa Rebyotan peräruiskeena painovoimavirtauksen avulla, jolloin potilas on vasemmalla kyljellään tai polvi-rinta-asennossa. 5.12 Potilaan tulee pysyä tässä asennossa enintään 15 minuuttia kouristuksen riskin vähentämiseksi, eikä vessan käyttöä sen jälkeen ole rajoitettu.
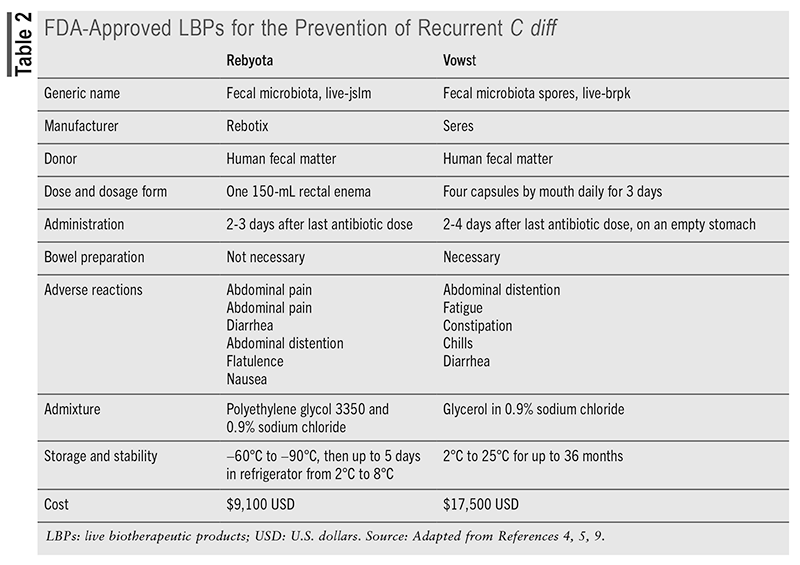
Lääkelaatuisista LBP-lääkkeistä Rebyota muistuttaa eniten perinteisiä FMT-hoitoja. Rebyota takaa erityiskäsittelyn ja vaatii säilytyksen pakastettuna ennen kuin se siirretään jääkaappiin 5 päivän kuluessa käytöstä. 5.10 Hankintavaihtoehtoina ovat tilaaminen erikoisjakelijan tai erikoisapteekin kautta ja sen hoitaminen terveydenhuollon ammattilaisella missä tahansa hoitopaikassa. Potilaille, joilla on sijaintirajoituksia, fyysisiä rajoituksia tai hallinnollisia haasteita, Rebyota @ Home -palvelu hallitsee prosessia, ja kotona olevat terveydenhoitajat koordinoivat hallintoa. 14
Kliininen tuki Rebyotan käytölle tulee pääasiassa neljästä julkaistusta kliinisestä tutkimuksesta, joita kutsutaan yhteisesti PUNCH-tutkimuksiksi. Rebyota osoitti jatkuvasti ylivoimaista tehokkuutta pelkkään antibioottihoitoon verrattuna rCDI:n estämisessä, ja yli 90 % menestyneistä potilaista pysyi uusiutumattomina kuuden kuukauden jälkeen. 5.9 Se on yleensä hyvin siedetty, ja yleisimmin raportoituja lieviä maha-suolikanavan sivuvaikutuksia, kuten vatsakipu (8,9 %), ripuli (7,2 %), vatsan turvotus (3,9 %) ja ilmavaivat (3,3 %). 9 Rebyota osoitti parannuksia terveyteen liittyvässä elämänlaadussa, kun otetaan huomioon lääkkeen hinta ja sen rooli sairaalahoitojen vähentämisessä. 12
Vowst (fecal microbiota itiöt, live-brpk) on FDA:n hyväksymä rCDI:n ehkäisyyn ja se on ensimmäinen suun kautta otettava LBP, joka toimitetaan kapseleissa, jotka on saatu terveiden luovuttajien ulostenäytteistä. 9.12 Vowst sisältää sekoituksen puhdistettuja itiöitä noin 50 lajista Firmicutes phylum, jotka toimivat palauttamalla suoliston mikrobiota ja estämällä suoliston itämistä, lisääntymistä ja toksiinien tuotantoa. C ero . 1.12 Luovuttajan uloste käy läpi etanolipohjaisen inaktivointivaiheen ei-itiöorganismien eliminoimiseksi, mitä seuraa suodatus sen eristämiseksi Firmicutes itiöt ja poista mahdolliset jäännökset. 9 Itiöpitoisuus mitataan sitten johdonmukaisuuden varmistamiseksi, jolloin saadaan standardisoitu sekoitus Firmicutes itiöitä, jotka kestävät maha-suolikanavan happoja suun kautta annettuna. 2.9
Potilaiden tulee olla suorittaneet anti- C ero antibiootteja ja odota 2–4 päivää viimeisen antibioottiannoksen jälkeen ennen kuin otat ensimmäisen Vowst-annoksen. 1.12 Lisäksi magnesiumsitraattia tulee ottaa Vowst-hoidon aloittamista edeltävänä iltana suoliston puhdistamiseksi ja mahdollisten maha-suolikanavassa olevien antibioottien neutraloimiseksi. 1,9,12 Neljä kapselia tulee ottaa päivittäin 3 peräkkäisenä päivänä (yhteensä 12 kapselia) tyhjään vatsaan ennen päivän ensimmäistä ateriaa. Vettä saa juoda vain vähän tänä aikana. 9.12 Reseptikapselit tilataan Vowstin nimeämän erikoisjakelijan tai erikoisapteekin kautta.
Neljä kliinistä tutkimusta osoitti Vowstin tehon, ja hoitoon liittyvät haittatapahtumat olivat pääasiassa lieviä tai kohtalaisia ja pääasiassa ruoansulatuskanavan aiheuttamia. Yhdessä tutkimuksessa CDI:n uusiutuminen 8 viikon sisällä oli 12 % Vowst-ryhmässä, kun taas lumeryhmässä 40 %. 9.12 Toisessa tutkimuksessa havaittiin, että Vowstin antaminen johti mikrobiomien korjaamiseen ja säilytti jatkuvan vasteen jopa 24 viikkoa hoidon jälkeen. 12 Päähyötynä havaittiin sen kyky palauttaa kolonisaatioresistenssi suolistossa ja lisätä metabolista kilpailua vastaan C ero . 1 Turvallisuustiedot osoittivat, että yleisimmät haittavaikutukset olivat vatsan turvotus (31 %), ummetus (14,4 %) ja ripuli (10,0 %). Yliherkkyysreaktio oli ainoa vakava haittatapahtuma. 5.9 Kuten muutkin LBP- ja FMT-toimenpiteet, myös Vowstiin kohdistuu varoituksia tarttuvien organismien leviämisriskistä.
Tutkinta LBP:t
RBX7455, jonka on myös kehittänyt Rebiotix, on standardoitu, lyofilisoitu LBP, jota parhaillaan testataan suun kautta käytettäväksi potilailla, joilla on rCDI. 5.15 Tämä tuote on valmistettu käyttämällä kaksinkertaisesti kapseloituja V-korkkeja, ja se on peräisin samoista mikrobeista, joita käytettiin Rebyota-peräruiskeessa. 15 Sen lisäksi, että RBX7455:tä käytetään rCDI:ssä, sen immunomoduloivia vaikutuksia arvioidaan sellaisissa olosuhteissa kuin rintasyöpä, maksaenkefalopatia ja Crohnin tauti. 5 Rebiotix aikoo hyväksyä RBX7455:n suun kautta otettavaksi vaihtoehdoksi Rebyotalle.
VE303 on tutkittava LBP, joka koostuu ainutlaatuisesta sekoituksesta Clostridial ja se annetaan suun kautta kapselina. 5.9 Toisin kuin muut LBP:t, jotka käyttävät ulosteen luovuttajamateriaalia, VE303 valmistetaan kahdeksasta eri materiaalista Clostridial siirtomaasolupankeista kasvatetut kannat, mikä voi parantaa yhdenmukaisuutta ja standardointia. 5.11 Se ei vaadi suoliston valmistelua ja sitä otetaan 10 kapselina päivässä 14 päivän ajan. 11 VE303 sai harvinaislääkeluokitusta vuonna 2017 ja Fast Track -luokitusta vuonna 2023 FDA:lta rCDI:n estämiseksi. 5 Sekä vaiheen I että vaiheen II tutkimukset ovat saavuttaneet ensisijaiset päätepisteet, mikä on lupaavaa tulevia laajamittaisia tutkimuksia varten. 1 Lisäksi VE303:a tutkitaan maksan enkefalopatian hoitoon. 5
Muita tutkittavia LBP:itä ovat Finch Therapeutics Groupin CP101 ja MaaT Pharman MET-2. 2.15 CP101 on oraalinen, kerta-annos, lyofilisoitu kapseli, joka sisältää monipuolisen mikrobiston, joka on saanut FDA:n läpimurtohoidon ja nopeutetun merkinnän. 1.5 Vaikka tiettyjä bakteerikomponentteja ja pesäkkeitä muodostavia yksiköitä annosta kohden ei julkisteta, Finch Therapeuticsilla on patentteja kohdennetuille hoidoille. C ero aktinobakteerien, proteobakteerien, firmicutien ja bakteroidien sekoituksella. 15 MET-2 sisältää 40 lajin patentoidun seoksen, joka on puhdistettu ja lyofilisoitu kapseleiksi oraalista käyttöä varten. Alun perin terveestä luovuttajan ulosteesta eristetty MET-2 valmistetaan luovuttajasta riippumattomasti luovuttajan terveyteen liittyvien riskien vähentämiseksi. 15,16
Farmaseutin rooli
Vuosikymmeniin ei ollut saatavilla lääkelaatuisia FMT-vaihtoehtoja ennen kuin FDA hyväksyi Rebyotan. FMT:n ulostemateriaali hankitaan usein jakkarapankeista, kuten voittoa tavoittelemattomasta OpenBiomesta. Nämä pankit keräävät, seulovat ja varastoivat terveiden luovuttajien ulosteita, joita lääkärit käyttävät sitten potilaiden hoitoon. 17 Siirtyminen perinteisestä FMT:stä farmaseuttiseen LBP:hen tarjoaa proviisoreille paremmat mahdollisuudet osallistua neuvontaan ja potilaiden hoitoon. Farmaseutit voivat osallistua useisiin LBP-toimituksen vaiheisiin, mukaan lukien hankinta, sairausvakuutuksen helpottaminen ja potilaiden neuvonta. Lisäksi, koska LBP-lääkkeet sisältävät aktiivisia bakteereja, niiden käyttö herättää huolta perinteisiin lääkkeisiin verrattuna, mikä korostaa lisätutkimuksen tarvetta täydentävien hoitojen ja tulosten parantamiseksi lääketurvatoiminnan avulla. 1 Kaiken kaikkiaan tehokas rCDI:n hoito edellyttää infektiotautilääkäreiden, proviisorien ja muiden asiantuntijoiden yhteistyötä kokonaisvaltaisen ja koordinoidun potilashoidon varmistamiseksi. 18
VIITTEET
1. Jain N, Umar TP, Fahner AF, Gibietis V. Edistyvät terapiat toistuviin Clostridioides difficile infektiot: yleiskatsaus lupauksen FDA:n hyväksyntään ja seurauksiin. Suoliston mikrobit. 2023;15(1):2232137.
2. Lavoie T, Appaneal HJ, LaPlante KL. Edistykset uusissa elävissä bioterapeuttisissa tuotteissa Clostridioides difficile infektioiden ehkäisy. Clin Infect Dis. 2023;77(lisäosa 6):s447-s454.
3. Mada PK, Alam MU. Clostridioides difficile infektio . Julkaisussa: StatPearls. StatPearls Publishing; 2024. www.ncbi.nlm.nih.gov/books/NBK431054/.
4. Gonzales-Luna AJ, Carlson TJ, Garey KW. Suoliston mikrobiotan muutokset liittyvät Clostridioides difficile infektio ja sen erilaiset hoitostrategiat. Suoliston mikrobit. 2023;15(1):2223345.
5. Stallhofer J, Steube A, Katzer K, Stallmach A. Mikrobiotaan perustuvat terapiat uusiutuvien hoitomuotojen hoitona Clostridioides difficile infektio. Visc Med. 2024;40(2):82-91.6. Aby ES, Vaughn BP, Enns EA, Rajasingham R. Ulosteen mikrobiotan siirron kustannustehokkuus ensimmäistä uusiutuvaa Clostridioides difficile infektio. Clin Infect Dis. 2022;75(9):1602-1609.
7. Johnson S, Lavergne V, Skinner AM, et ai. Infectious Diseases Society of America (IDSA) ja Society for Healthcare Epidemiology of America (SHEA) kliinisen käytännön ohje: 2021 keskittynyt päivitysohjeiden hallintaan Clostridioides difficile infektio aikuisilla. Clin Infect Dis. 2021;73(5):e1029-e1044.
8. Wang Y, Hunt A, Danziger L, Drwiega EN. Tällä hetkellä saatavilla olevien ja tutkittavien ulosteen mikrobiotan siirtotuotteiden vertailu uusiutuvien bakteerien varalta Clostridioides difficile infektio. Antibiootit (Basel). 2024;13(5):436.9. Grigoryan Z, Shen MJ, Twardus SW, et ai. Ulosteen mikrobiotan siirto: käyttötarkoitukset, kysymykset ja etiikka. Med Microecol. 2020; 6:100027.
10. Davidovics Z. Ulosteensiirto. Julkaisussa Wyllie R, Hyams JR, Kay M, toim.: Lasten maha-suolikanavan ja maksasairaudet. 6. painos Elsevier; 2021:1039-1042.
11. Barron M. Ulosteen mikrobiotasiirrot (FMT): menneisyys, nykyisyys ja tulevaisuus. ASM.org. 2024. https://asm.org/articles/2024/february/fecal-microbiota-transplants-past-present-future. Accessed August 8, 2024.
12. Gonzales-Luna AJ, Carlson TJ, Garey KW. Tarkista artikkeli: elävien bioterapeuttisten tuotteiden turvallisuus, joita käytetään ehkäisyyn Clostridioides difficile infektion uusiutuminen. Clin Infect Dis. 2023;77(Suppl 6):S487-S496. 13. Jolaiya T, Smith S. Kehittyvät tekniikat maha-suolikanavan mikrobiomien aikakaudella ja niiden mahdolliset kliiniset sovellukset. Julkaisussa: Pellicano R, Fagoonee S, Ajayi A, toim. 3T:t ruoansulatuskanavan mikrobiomien aikakaudella: tekniikka, translaatiotutkimus ja siirto. MDPI; 2021:4.
14. DuPont HL, DuPont AW, Tillotson GS. Mikrobiootan palautushoidot toistuviin Clostridioides difficile tartunta saavuttaa uuden tärkeän virstanpylvään. Therap Adv Gastroenterol. 2024; 17:9.
15. McChalicher CW, Auniņš JG. Mikrobiomin ja bakteerien elävän bioterapeuttisen konsortion tuotannon huumettaminen. Curr Opin BIotechnol. 2022;78:102801.
16. Rebyotan hoidon pääkohdat: Rebyotan anto – yksi annos. Yksi täydellinen mikrobiomipohjainen bioterapeuttinen lääke. 5. kesäkuuta 2024. www.rebyotahcp.com/why-rebyota/#rebyota-administration-highlights. Accessed October 3, 2024.17. Kao D, Wong K, Franz R, et al. The effect of a microbial ecosystem therapeutic (MET-2) toistuvasti Clostridioides difficile infektio: vaihe 1, avoin, yhden ryhmän tutkimus. Lancet Gastroenterol Hepatol. 2021;6(4):282-291:8.
18. Haber SL, Raney CRK, Larson TL, Lau JP. Ulosteen mikrobiotan siirto uusiutuvia varten Clostridioides difficile infektio. Am J Health Syst Pharm. 2019;76(13):935-942.
Tämän artikkelin sisältö on tarkoitettu vain tiedoksi. Sisältöä ei ole tarkoitettu korvaamaan ammattiapua. Tässä artikkelissa annettuihin tietoihin luottaminen on täysin omalla vastuullasi.











